推荐产品
公司新闻/正文
新型抗肿瘤生物治疗药物(一)——抗肿瘤核酸疫苗 (舜纳纳米 免疫载体)
人阅读 发布时间:2020-12-28 00:27
除了新型的分子靶向药物外,其他新型的抗肿瘤药物也在研发中,包括基因治疗、抗肿瘤疫苗、抗肿瘤中药等。例如,美国 Antigenics 公司在俄罗斯获准上市的肿瘤疫苗(商品名:Oncophage),可用于治疗复发危险在中间程度的肾癌患者。再如,世界上第一个以肿瘤为靶向的基因药物,Epeius 生物技术公司的抗癌基因纳米粒注射剂(商品名:Rexin-G),已于 2009 年底获得到菲律宾食品药品局(BFAD)颁发的产品注册证书。此外,2009 年,法国医药管理局率先批准 Ark Therapeutics 公司患者供应腺病毒载体定位码基因注射剂(商品名 Cerepro)上市,作为罕用药物治疗可行手术的恶性神经胶质瘤。
其中,核酸疫苗的概念出现于二十多年前,当时发现给小鼠骨骼肌注射 mRNA 或者质粒 DNA(pDNA) 后,核酸编码的相应蛋白得到了表达。核酸疫苗的早期研究聚焦于 DNA, 因为 DNA 比 RNA 稳定。但是发现 pDNA 在人体内不能产生足够强的抗体应答,尽管通过体内电穿孔局部给药方法可以显著提高效率。借助于病毒载体接种 pDNA、mRNA 或自我复制型 RNA 的策略在灵长目动物和人身上都可以诱导很强的免疫应答,但开发这类疫苗还存在抗载体免疫反应和安全问题等主要障碍。肿瘤 DNA 疫苗的原理就是将编码肿瘤特异性抗原的裸 DNA 分子直接注入机体或者经载体携带后注入机体,肿瘤 DNA 被体内肿瘤细胞或正常细胞识别并摄入,在细胞内表达肿瘤特异性抗原,引发机体持久的细胞和体液免疫。后续的研究则对抗肿瘤的 DNA 疫苗的靶标和设计进行了深入探索。在靶标研究中,例如,以转录因子 Fos 相关抗原 1 为靶标的 DNA 疫苗可以有效地抑制肿瘤血管生长,从而抑制乳腺癌的生长和迁移。又如,自然杀伤细胞(Natural killer cell,NK)和活化的 CD8+ T 细胞上表达的受体 NKG2D 参与免疫调节,编码同源或异源 NKG2D 的 DNA 疫苗可以激活天然免疫和获得性免疫应答。此外,通过抗血管生成来抑制肿瘤的 DNA 疫苗设计也得到了优化。
在 DNA 疫苗的抗肿瘤动物实验中,近期在乳腺癌治疗研究等方面取得了突破性发展。底特律韦恩州立大学(Wayne State University)医学院卡门诺斯 (Karmanos) 癌症研究所的林维仁团队将 DNA 疫苗注入老鼠肌肉细胞,快速唤醒免疫系统,使其辨识 HER-2 分子,这一可预防 HER-2 型乳癌分子增生的刺激免疫系统新疫苗在老鼠实验的研究中获得了成功。
肿瘤 DNA 疫苗的实验室成果在临床研究中得到了应用。Ⅰ期临床试验中,gp100 和粒细胞-巨噬细胞集落刺激因子(GM-CSF)cDNA 可以在黑色素瘤患者体内诱导免疫应答,而Ⅰ/Ⅱ期临床试验也证明 GM-CSF DNA 可以在进展期黑色素瘤内作为多肽癌症疫苗佐剂安全地使用。但是,日本武田制药和美国 Cell Genesys 公司的前列腺癌疫苗合作开发的 GVAX 在以进行性前列腺癌患者为对象的 III 期临床试验「VITAL-2」中,因 GVAX 用药组死亡率高于对照组,于 2008 年中止该项试验。
但与 DNA 疫苗相比,RNA 疫苗优点更多。RNA 疫苗几乎无整合到宿主细胞基因组的危险, RNA 疫苗可保留编码病毒复制酶的非结构蛋白基因,从而促进载体 RNA 在胞浆内的高水平扩增与表达。尽管对核酸(DNA 和 RNA)疫苗的研究已有几十年的历史,但至今仍然没有相关人用产品上市。最近,Geall 及其同事在 PNAS(美国科学院院报) 上报道了一种新型核酸疫苗:包裹在合成的脂质纳米颗粒 (LNPs) 中且具有自我复制功能的 RNA,此技术平台克服了早期核酸技术的一些缺点。
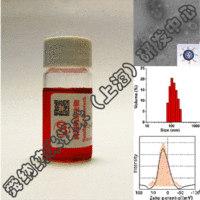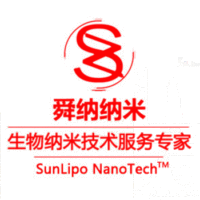
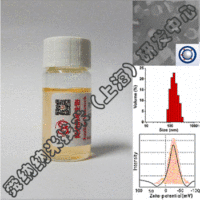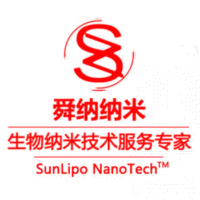
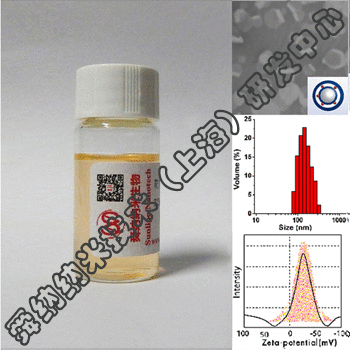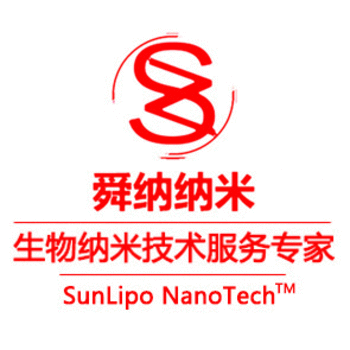
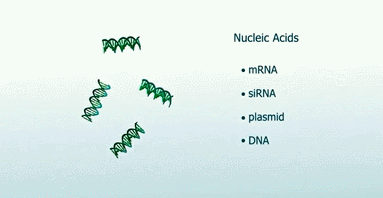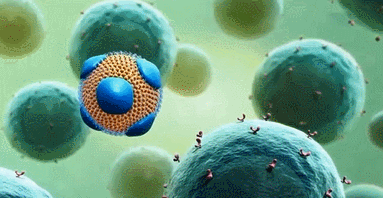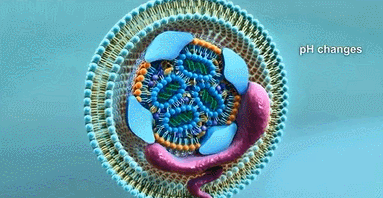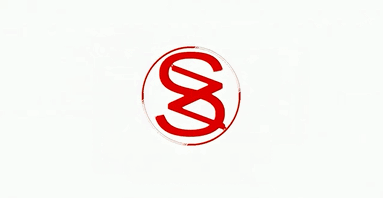
舜纳生物可提供工业RNA纳米载体构建技术,把RNA包裹到LNP中不仅可以防止酶对RNA的降解,还可以提高肌肉注射后组织对基因的摄取效率。重要的是LNP表面不含有任何表面蛋白,因此不会受抗载体免疫反应的干扰。自我复制RNA来源于甲病毒基因组,其中编码结构蛋白的基因被靶抗原的编码基因取代,原有的RNA复制元件则保留。由于RNA复制和蛋白表达都在靶细胞的细胞质中进行,RNA不需要穿越核膜(已发现这是核酸疫苗的一个限速因素),因而也不存在RNA整合到细胞基因组的风险。
利用生物发光报告基因发现,RNA通过LNP给药,基因表达持续时间是通过病毒载体技术 (即病毒复制颗粒) 给药的两倍。作者通过呼吸道合胞病毒(RSV)感染模型为自己的观点提供了证据。LNP-RNA疫苗在棉鼠中可诱导产生中和抗体,在小鼠中可诱导CD4+和 CD8+T细胞产生抗原特异性干扰素-γ。LNP/RNA疫苗诱导的免疫反应达到甚至超过了RNA的VRP给药或者pDNA的电穿孔给药,而且能针对随后的RSV感染提供保护。
值得指出,LNP/RNA疫苗在体外以无细胞形式生产,容易规模化生产,具有成本效益的优势,且可避开在用细胞培养方法制备活病毒疫苗、亚单位蛋白或病毒载体时在安全和生产方面的相关问题。因此该方法可能提供潜在的通用技术平台,用来生产能同时诱导体液免疫和细胞免疫反应的高效的通用疫苗。具体可关注我们所供应产品——DNA&RNA核酸抗肿瘤疫苗载体(iV, iP, iH免疫因子载体)。

值得分享的是,舜纳纳米自成立以来,坚持“专注转化 服务医工”的践行理念,先后为多家上市生物医药及创新器械企业提供生物纳米技术开发,并与全国近百家医疗单位开展纳米医疗技术研发合作,有效开展医工交叉实践,获得了良好的产业信任与业内口碑;并依托纳米医学网将自身的优势技术与医疗平台的“辐射”能力,加速推进新材料、新技术在免疫、肿瘤、心血管、骨科、眼科、皮肤等六大临床中心的实践转化,积极促进合作技术项目的开发及转化。在可见的未来,舜纳将与医工各界人士深入合作,为健康医疗事业提供更好的服务与产品。
上海舜纳生物科技有限公司 纳米医学技术研发中心 Sunlipo Biotech Research Center for Nanomedicine
邮箱:sunlipotech@163.com(技术服务)info@med-nanotech.com(应用开发)
电话:86-21-5127 9909 传真:86-21-5193 6393
阳离子纳米复合、siRNA脂质体、阳离子聚合物、pamam、核酸PAMAM、阳离子高分子、树枝物、